Entkalkungstiefe
Viele Ausgangsgesteine sind
kalkhaltig, so enthalten z.B. die meisten Moränen, aber auch Schotter
mit hohem Kalkgehalt, Karbonatanteile von 40 bis 60 %. Dies reicht aus,
um verdünnte Salzsäure sehr gut sichtbar zum Aufschäumen
zu bringen. Als "entkalkt" bezeichnet man einen Boden dann,
wenn die verdünnte Salzsäure nicht mehr reagiert.
Zum Aufschäumen kommt es durch die Freisetzung von CO2
nach der Formel:
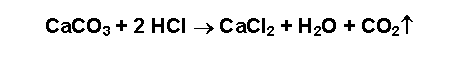
Die Verwitterung ist zwar nicht
annähernd so intensiv und aggressiv wie die verdünnte Salzsäure,
doch im Laufe der Zeit sind auch die protolytischen und hydrolytischen
Verwitterungsprozesse in der Lage, das Calciumkarbonat sukzessive im Boden
zu lösen und mit Hilfe des Wassers abzuführen. Vor allem im
Bereich der Wurzeln, wo infolge der Wurzelatmung sowie der mikrobiellen
Tätigkeit viel CO2 bereit gestellt wird, kann
Calciumkarbonat gut gelöst werden. Das CO2
dissoziiert in Wasser zu Kohlensäure, deren H+-Ionen das schwer lösliche
Karbonat in wesentlich leichter lösliches Hydrogenkarbonat überführen.
Die Entkalkung greift also parallel zur Verwitterung von oben her in den
Boden ein. In beiden Fällen gilt: je tiefer der Prozeß gewirkt
hat, desto älter ist das Material. Deshalb wird häufig die Entkalkungstiefe
mit der Verwitterungstiefe gleichgesetzt. Die Entkalkungstiefe kennzeichnet
demnach auch die Grenze zwischen verwittertem und unverwittertem Material,
also zwischen entkalktem B-Horizont und kalkhaltigem C-Horizont. So kann
die Lage des Ausgangsgesteins ausgemacht werden.
Zur Anwendung dieser Methode eignen sich 5- bis 15-prozentige Salzsäure,
die in der Apotheke zu kaufen ist. Das Aufschäumen ist mit bloßem
Auge sichtbar und i.d.R. auch gut hörbar. Die einfache Durchführung,
ohne Labor und vor Ort, macht die Methode für das Gelände besonders
empfehlenswert, wenngleich das Arbeiten mit der ätzenden Salzsäure
durch die Schülerinnen und Schüler nicht unproblematisch ist.